



La microscopía óptica es una técnica que permite la observación de muestras en su mayoría traslúcidas, o en el caso de ser opacas, con una superficie de reflexión que no se encuentra perfectamente pulida. La luz incide sobre la muestra a distintas profundidades, generando una imagen borrosa debido a la detección de luz procedente de zonas fuera del plano de enfoque, lo que provoca una importante degradación en la nitidez, contraste y resolución de la imagen.
La microscopía láser confocal aparece con gran éxito tras el desarrollo del láser, logrando excelentes resultados en diversas disciplinas (medicina, biología, geología, etc.), debido a sus indudables ventajas frente a la microscopía óptica tradicional. El principio de la microscopía láser confocal se basa en la eliminación de la luz reflejada o fluorescencia procedente de los planos fuera de foco. Para ello, se ilumina la muestra punto por punto con una línea de láser y se detecta únicamente la luz que proviene del plano focal, eliminándose los haces de los planos inferiores y superiores, generando de esta manera imágenes de elevada nitidez, contraste y resolución. Además, con la microscopía láser confocal se pueden obtener secciones ópticas de la muestra, lo que permite su estudio tridimensional.
La microscopía de Fluorescencia de Reflexión Interna Total (TIRF) se basa en un tipo de iluminación que genera una onda o campo evanescente de un grosor aproximado de 100 nm, produciendo la excitación de una región limitada de la muestra, localizada adyacente a la interfase entre dos medios que presentan distintos índices de refracción. En la práctica, la interfase más comúnmente utilizada en TIRF, es el área de contacto entre la membrana plasmática basal de la célula y el vidrio o sustrato sobre el que se adhiere la célula. La microscopía TIRF permite llevar a cabo un amplio rango de aplicaciones en biología celular, como analizar la localización y distribución dinámica de moléculas fluorescentes cerca de la membrana plasmática basal de las células.
La técnica de microdisección por captura láser se centra en la observación y separación de células únicas o pequeños grupos celulares de un tejido heterogéneo de manera selectiva, eficiente y rápida, lo que posibilita el estudio sistemático de la calidad y cantidad de biomoléculas (DNA, RNA o proteínas) en poblaciones celulares específicas. Esta tecnología, que originalmente fue desarrollada para el análisis molecular de tumores, hoy puede ser aplicada a una gran variedad de tejidos, y facilita el estudio de las bases moleculares de numerosas enfermedades, como aquellas asociadas a la variabilidad genética humana, tales como cáncer, enfermedades raras, enfermedades degenerativas, diabetes e hipertensión, entre otras.
La Unidad de Microscopía e Imagen Molecular en GENYO se dedica a la aplicación y el desarrollo de diferentes técnicas avanzadas de microscopía láser confocal, como el análisis de la localización y distribución dinámica de moléculas de interés en células o modelos animales, abriendo un abanico muy amplio de nuevas posibilidades a la hora de abordar estudios dinámicos de procesos celulares. También cuenta con equipamiento específico para realizar la técnica de microscopía de Fluorescencia de Reflexión Interna Total (TIRF), con el fin de visualizar procesos de movilidad celular, agregación y adhesión de proteínas, endocitosis, exocitosis y transporte de vesículas entre otros, procesos localizados en la región de la membrana plasmática basal de las células. Asimismo, en la unidad se lleva a cabo la técnica de microdisección por captura láser, que permite el aislamiento de poblaciones celulares puras o células individuales para su posterior estudio genómico o proteómico.
Misión
La Unidad de Microscopía e Imagen Molecular tiene como labor principal proporcionar apoyo técnico en las áreas de la microscopía de epifluorescencia, microscopía láser confocal, microscopía TIRF y microdisección por captura láser, tanto a los grupos de investigación del centro, como a entidades externas.
Gracias al equipamiento tecnológico de última generación que posee la unidad, y a la gran experiencia del personal responsable científico y técnico en microscopía de epifluorescencia, microscopía confocal avanzada, microscopía TIRF y microdisección láser, es posible desarrollar las aplicaciones requeridas por los usuarios, y alcanzar una de las prioridades de GENYO, como es la integración de la investigación básica, aplicada y traslacional, minimizando los tiempos entre el desarrollo de nuevas tecnologías, productos y procedimientos y su aplicación en el ámbito sanitario. Así como participar en la generación de nuevos sistemas de diagnóstico, prevención y tratamiento de enfermedades asociadas a la variabilidad genética humana mediante la aplicación de las nuevas tecnologías basadas en imagen molecular, con el fin de lograr una investigación de excelencia en el área de oncología y genómica aplicada a la salud.
Áreas de actuación
La Unidad de Microscopía e Imagen Molecular centra su actividad en la microscopía de epifluorescencia, la microscopía láser confocal y la microscopía TIRF, que permiten analizar la localización de moléculas de interés mediante técnicas de inmunofluorescencia o fusión a proteínas fluorescentes (CFP, GFP, YFP, mRFP, mCherry, etc.) tanto en células fijadas como vivas, lo que posibilita abordar entre otros, estudios de procesos celulares dinámicos. Asimismo, en la unidad se lleva a cabo la actividad de microdisección por captura láser, que facilita el aislamiento de poblaciones celulares específicas en secciones tisulares heterogéneas o de células individuales para su posterior estudio genómico o proteómico.
Microscopía de Epifluorescencia:
La microscopía de epifluorescencia utiliza como fuente de iluminación la luz procedente de una lámpara que emite a distintas longitudes de onda, mediante un filtro se selecciona la longitud de onda de excitación adecuada dependiendo del fluorocromo presente en la muestra, de tal forma que la luz reflejada o fluorescencia emitida por el espécimen después de atravesar un sistema de filtros de emisión, llega al detector o cámara, obteniéndose finalmente la imagen digital en el ordenador.
La Unidad de Microscopía e Imagen Molecular de GENYO está dotada de diversos equipos de microscopía de epifluorescencia como: Nikon Eclipse 50i, Nikon Eclipse TE2000-U y Zeiss Axio Imager A.1, que permiten la adquisición de imágenes con técnicas de luz transmitida (campo claro, contraste de fases y contraste interferencial (DIC)), así como la adquisición de imágenes de fluorescencia a partir de muestras fijadas que presentan un sólo fluorocromo (marcaje simple) o varios (marcaje múltiple).
Microscopía Láser Confocal:
La microscopía láser confocal, a diferencia de la microscopía de epifluorescencia, permite obtener imágenes de alta resolución, nitidez y contraste de un único plano focal de la muestra al eliminar la luz procedente de los planos fuera de foco. El microscopio láser confocal adquiere imágenes de muestras que reflejan la luz emitiendo fluorescencia, siendo en este caso la fuente de iluminación el láser, que excita punto por punto el espécimen y mediante un sistema de barrido, puede desplazarse por todo el plano focal. La fluorescencia emitida por el plano focal de la muestra es detectada por un fotomultiplicador y transformada en una señal electrónica que se digitaliza y almacena en un ordenador, visualizándose una imagen de elevada calidad a través del monitor.
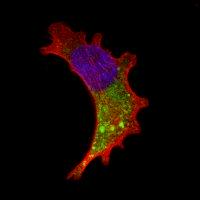 El microscopio láser confocal permite estudiar muestras marcadas con varios fluorocromos, recogiendo las señales emitidas por éstos sin solapamiento mediante la detección a medida de los espectros de emisión de cada fluorocromo. Se genera de esta forma múltiples imágenes, una por cada fluorocromo detectado, que finalmente pueden superponerse en una sola imagen.
El microscopio láser confocal permite estudiar muestras marcadas con varios fluorocromos, recogiendo las señales emitidas por éstos sin solapamiento mediante la detección a medida de los espectros de emisión de cada fluorocromo. Se genera de esta forma múltiples imágenes, una por cada fluorocromo detectado, que finalmente pueden superponerse en una sola imagen.
Una de las grandes ventajas de la microscopía confocal es la posibilidad de variar la posición del plano focal y poder capturar imágenes a distintas alturas en el eje Z de la muestra, obteniendo de esta manera un conjunto de secciones ópticas a las que es posible aplicar técnicas de reconstrucción que nos permiten visualizar la estructura tridimensional del espécimen.
En el campo de la microscopía láser confocal, GENYO dispone de tecnología de última generación como es el Microscopio Láser Confocal LSM 710 (Zeiss), dotado de cámara de incubación con control de CO2 y temperatura para abordar ensayos con muestras vivas.
Microscopía de Fluorescencia de Reflexión Interna Total (TIRF):
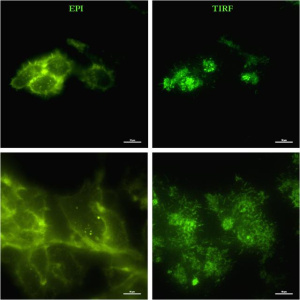
La microscopía de Fluorescencia de Reflexión Interna Total (TIRF), también conocida como “microscopía por onda evanescente”, se basa en la excitación selectiva de fluoróforos localizados en un ambiente acuoso o celular, muy cercanos a la zona basal o de interfase muestra/vidrio, sin llegar a excitar a los fluoróforos situados por encima de esta región. En la microscopía TIRF, la onda evanescente es generada por una luz de excitación que incide con un ángulo específico sobre la interfase entre el cubreobjetos y la muestra, que permite la reflexión interna total de la luz, produciendo un campo electromagnético en la zona de interfase de la misma frecuencia que la luz incidente, de un grosor aproximado de 100 nm, y cuya intensidad decae exponencialmente con la distancia a la interfase. Gracias a la microscopía TIRF se pueden obtener imágenes de elevado ratio señal/ruido en la zona de contacto muestra/vidrio, sin contribución de la fluorescencia procedente del resto del volumen de la muestra.
La microscopía TIRF ha permitido desarrollar numerosas aplicaciones en el campo de la biología celular como: la visualización específica de las regiones de contacto célula/vidrio o célula/sustrato, detección y espectroscopía de molécula única localizada en la zona de interfase muestra/vidrio, procesos de endocitosis y exocitosis, tráfico vesicular, distribución de proteínas en la membrana plasmática basal de las células, procesos de adhesión célula-célula, estudios dinámicos del citoesqueleto en células vivas, entre otros.
La microscopía TIRF presenta ciertas ventajas frente a otros tipos de técnicas, ya que permite obtener imágenes con mayor señal y menor ruido que la microscopía de epifluorescencia en las zonas de contacto entre la membrana plasmática basal de las células y el vidrio o sustrato sobre el que se adhieren, así como poder realizar una sección óptica más fina y en un periodo de tiempo más corto que la microscopía láser confocal, en una región muy específica como es la zona de interfase muestra/vidrio.
La Unidad de Microscopía e Imagen Molecular de GENYO está dotada de un Microscopio de Epifluorescencia Nikon Eclipse Ti-E con módulo TIRF, equipado con diferentes líneas de láser, un objetivo 100x de gran apertura numérica (1.49), una cámara EM-CCD monocroma de alta sensibilidad espectral y velocidad, así como de un sistema de incubación para realizar ensayos de adquisición de imágenes de fluorescencia a lo largo del tiempo con muestras vivas bajo condiciones controladas de CO2 y temperatura.
 Microdisección por Captura Láser:
Microdisección por Captura Láser:
La microdisección por captura láser permite el aislamiento de regiones de interés a partir de secciones tisulares criocongeladas o FFPE, poblaciones celulares o incluso células individuales específicas a partir de muestras fijadas o vivas, marcadas con técnicas de inmunohistoquímica, inmunofluorescencia o que expresan moléculas de interés fusionadas a proteínas fluorescentes, para posteriormente realizar su estudio genómico o proteómico.
La imposibilidad de aislar grupos puros de células representaba una limitación fundamental en el estudio de un tipo celular concreto, hasta que la aparición y evolución de las técnicas de microdisección, dio lugar a la microdisección por captura láser, una técnica eficaz, precisa y totalmente libre de contaminación ambiental, destinada a investigadores interesados en separar poblaciones celulares o células únicas específicas para su posterior análisis molecular.
La Unidad de Microscopía e Imagen Molecular cuenta con importante tecnología en el área de la microdisección por captura láser, como es el Microdisector Láser PALM Microbeam IV (Zeiss). Las secciones de tejido o células se observan con el microscopio óptico invertido Axio Observer Z.1 (Zeiss), que proporciona una alta calidad de imagen. A través del monitor del ordenador equipado con el software PALMRobo, se pueden localizar las áreas de tejido o células de interés de manera rápida y fácil. A continuación, el dibujo a mano alzada o mediante figuras predeterminadas permite seleccionar grupos celulares o células únicas, que serán cortados de forma automática y precisa por el láser UV (355 nm) y catapultados en la tapa adhesiva del tubo colector para su posterior estudio molecular. Además, el microdisector láser cuenta con un sistema “Cap Check” para comprobar la presencia de la muestra catapultada en el tubo colector, proporcionando de esta forma una mayor fiabilidad al sistema.
Técnicos de apoyo a la investigación:
Alba Pañella Alférez
Contacto de la unidad:
unidad.microscopia@genyo.es
Listado de servicios:
Equipamiento
La Unidad dispone de los siguientes equipos de microscopía de epifluorescencia, microscopía láser confocal, microscopía TIRF y microdisección por captura láser, cuyas principales características son:
Microscopios de Epifluorescencia:

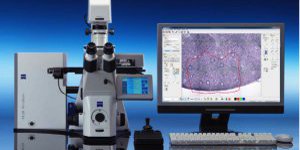
Microscopio Láser Confocal Zeiss LSM 710:
 |
 |
Microscopio Epifluorescencia con módulo TIRF Nikon Eclipse Ti-E:

Microdisector Láser Zeiss PALM Microbeam IV:
 |
 |
Softwares de adquisición, procesamiento y análisis de imagen:
 Intranet
Intranet