No se ha encontrado investigadores para este término.
En las últimas décadas, numerosas evidencias científicas han demostrado la presencia de un componente genético en la etiología de tumores sólidos y neoplasias hematológicas, así como en los estadios pretumorales de estas últimas, incluyendo la gammapatía monoclonal de significado incierto (GMSI) o la linfocitosis monoclonal de células B (LMCB).
Aunque las técnicas convencionales de análisis citogenético (cariotipo y FISH) y los perfiles mutacionales han demostrado ser muy útiles en el diagnóstico y pronóstico de estas patologías, su uso ha puesto de manifiesto la existencia de importantes limitaciones. Además del estudio de las aberraciones cromosómicas, el análisis simultáneo de miles de variaciones genéticas y epigenéticas con las nuevas tecnologías desarrolladas en el campo de la genómica ha adquirido un valor práctico en el diagnóstico y clasificación de las neoplasias hematológicas y los tumores sólidos y, recientemente, se ha sugerido que, a diferencia del análisis citogenético, este tipo de abordaje también puede conducir al desarrollo de nuevas herramientas pronósticas, al descubrimiento de nuevas dianas terapéuticas y a la implementación de estrategias de tratamiento más individualizadas. Sin embargo, a pesar de los espectaculares avances tecnológicos en genómica funcional y estructural, todavía son pocas las variaciones genéticas que se han identificado de forma inequívoca como asociadas a la susceptibilidad a estas patologías y, sobre todo, a su progresión.
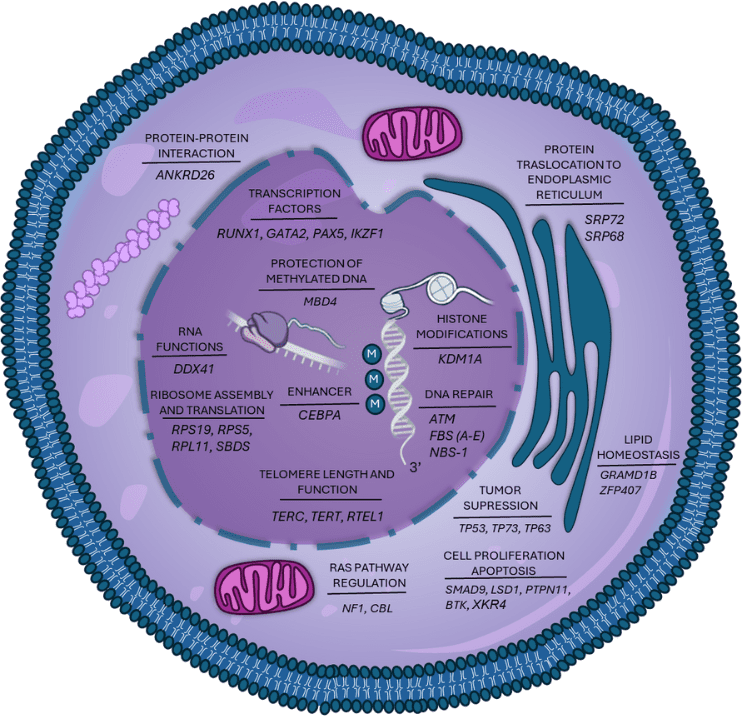
Figura 1. Algunas de las mutaciones más relevantes implicadas en la determinación de la susceptibilidad a las neoplasias hematológicas.
Es por ello que nuestro grupo de investigación centra sus esfuerzos en esta línea y trata de identificar variaciones genéticas (SNPs, mutaciones, ins/del, CNVs, etc…) implicadas en estos procesos, así como en el desencadenamiento de algunas complicaciones clínicas asociadas como la enfermedad injerto contra huésped y las infecciones por patógenos oportunistas (en particular, hongos Aspergillus). Paralelamente, nuestro grupo se plantea también el análisis de la interacción de las variaciones genéticas con factores ambientales y el estudio del papel de estas variaciones genéticas en la respuesta a fármacos con especial atención a los utilizados en tratamientos quimioterapéuticos.
Históricamente, las estrategias elegidas para nuestros estudios han sido fundamentalmente las basadas en el estudio de genes candidatos seleccionados en función de vías relevantes en cada patología, tales como autofagia, proliferación, apoptosis y regulación de telómeros.
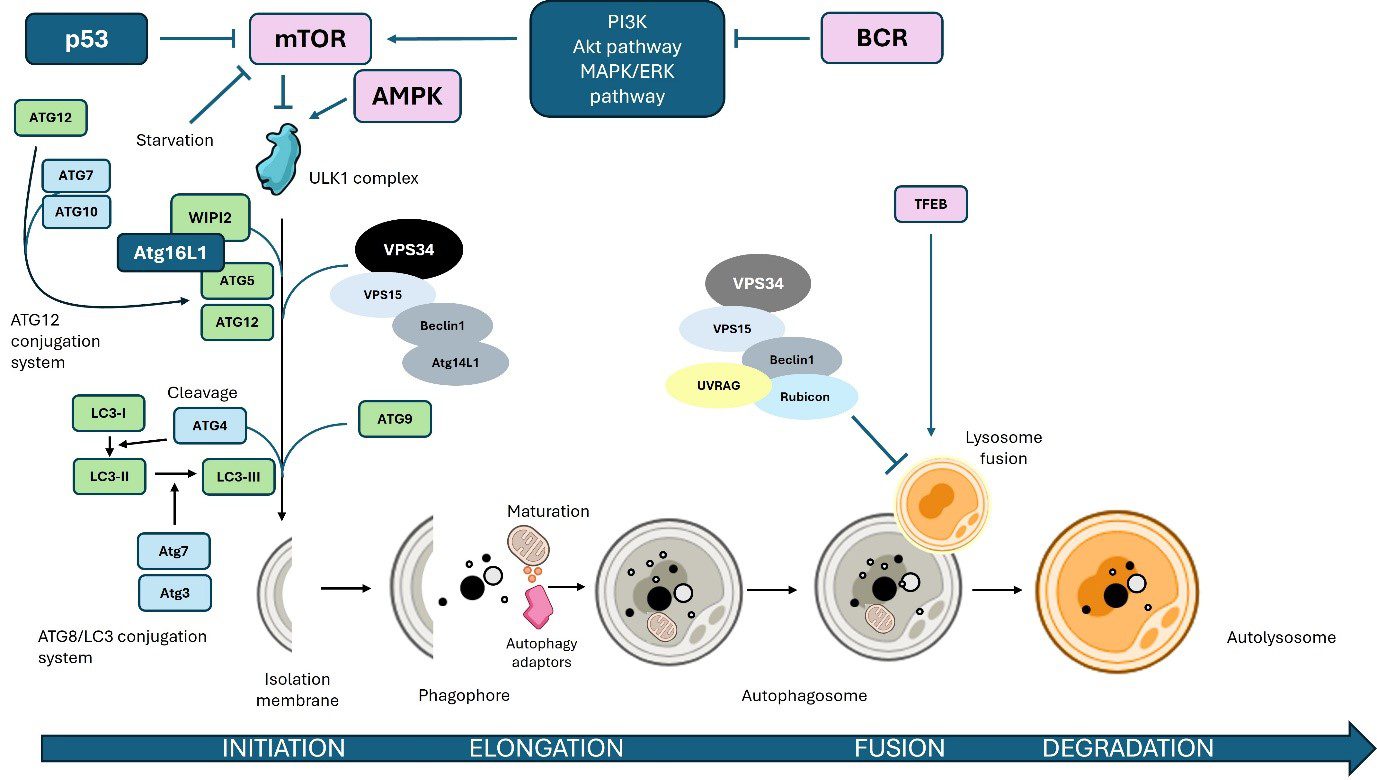
Figura 2. Vía de la autofagia. Una vía estudiada intensamente por nuestro grupo tanto en trastornos sanguíneos malignos como en tumores sólidos.
En los últimos años se están llevando a cabo estudios de genómica estructural orientados al análisis masivo de variaciones en el genoma como los GWAS (Genome-wide association studies), las técnicas de secuenciación de nueva generación, el análisis de perfiles de expresión y metilación génica y la determinación de la longitud de los telómeros.
El uso de estas técnicas moleculares junto con estudios funcionales está permitiendo la identificación de genes implicados en la susceptibilidad y la mejora en la comprensión de la biología y etiopatogenia de muchas enfermedades multifactoriales, así como en la gestión de la terapia basada en una gran cantidad de información genética disponible. Asimismo, el uso de estas nuevas tecnologías está permitiendo profundizar en el análisis del genoma tumoral y facilitar la identificación de mutaciones específicas en determinados tipos de tumores, lo que sin duda acerca aún más la posibilidad de identificar nuevas dianas terapéuticas y adaptar las estrategias de tratamiento.
LÍNEAS DE INVESTIGACIÓN
Línea 1: Genética de las neoplasias hematológicas.
La mayoría de las neoplasias hematológicas están muy bien caracterizadas desde el punto de vista citogenético y, aunque se conoce bien qué alteraciones cromosómicas se producen en cada una de ellas y cuál es su valor pronóstico, cada vez es más evidente que estas alteraciones no explican completamente la base genética de estas enfermedades y que son necesarias otras alteraciones genéticas y epigenéticas para la aparición de las mismas. Teniendo en cuenta estos hechos y al igual que la línea de investigación desarrollada en mieloma, nuestro grupo de investigación, en colaboración con otros investigadores a nivel nacional, pretende encontrar aquellos polimorfismos genéticos que determinan el riesgo de desarrollar neoplasias hematológicas, así como determinar la influencia de la interacción de estas alteraciones genéticas con factores ambientales. Por otro lado, esta línea de investigación también pretende caracterizar el perfil genético asociado a la respuesta a las diferentes terapias utilizadas en primera y sucesivas líneas de tratamiento, así como establecer las consecuencias biológicas de estas alteraciones mediante ensayos funcionales.
Línea 2: Genética de la gammapatía monoclonal de significado incierto (GMSI) y la linfocitosis monoclonal de células B (LMCB)
El mieloma múltiple (MM) o la leucemia linfocítica crónica (LLC) son neoplasias hematológicas muy heterogéneas que se desarrollan a partir de estadios premalignos como la gammapatía monoclonal de significado incierto (GMSI) o la linfocitosis monoclonal de células B (LMCB). Aunque en los últimos años se ha avanzado considerablemente en la comprensión de la etiopatogenia de estos estados pretumorales, aún se desconocen los mecanismos moleculares que subyacen al proceso de transformación tumoral. En el caso de la GMSI, por ejemplo, la hipótesis más aceptada es que puede deberse a la acumulación de ciertas alteraciones genéticas, como translocaciones en las regiones variables de las cadenas pesadas de las inmunoglobulinas (IgH) (11q13, 4p16, 16q23, 21q12 y 6p21), deleciones en el cromosoma 13 y trisomías de los cromosomas 3, 5, 9, 11, 15, 19 y 21, así como una desregulación de la expresión del gen de la ciclina D. Sin embargo, estudios recientes han demostrado que, además de estas alteraciones cromosómicas, la presencia de polimorfismos de nucleótido único (SNP) puede influir en el desarrollo de la enfermedad tumoral, así como en el grado de progresión del tumor. Partiendo de esta hipótesis, el principal objetivo de nuestro grupo es identificar variaciones genéticas asociadas a MGUS y CMLB que puedan ayudarnos a comprender los mecanismos subyacentes a la tumorogénesis.
Línea 3: Infecciones relacionadas con el cáncer
Las infecciones desempeñan un papel muy relevante en el manejo de los pacientes con cáncer. Uno de los ejemplos más destacados es la aspergilosis invasiva (AI), una infección mortal causada principalmente por hongos del género Aspergillus que con frecuencia coloniza las vías respiratorias y se propaga rápidamente a los vasos sanguíneos y los tejidos en individuos inmunodeprimidos.
Figura 3. Aspergilosis pulmonar invasiva, una complicación clínica frecuente en pacientes con cáncer.
La incidencia de esta infección ha aumentado en los últimos años debido al uso de potentes inmunosupresores y fármacos inmunomoduladores, y en la actualidad sigue presentando una elevada morbimortalidad en todo el mundo, especialmente en pacientes inmunodeprimidos y sometidos a trasplante de precursores hematopoyéticos. Aunque en las últimas décadas se han identificado varios factores de riesgo relacionados con el desarrollo de la AI (defectos en la función fagocítica, el uso de corticosteroides y antibióticos de amplio espectro, la neutropenia prolongada inducida por la quimioterapia, así como la existencia de episodios previos de infección), sigue siendo extremadamente difícil prevenir y diagnosticar esta enfermedad infecciosa en una fase temprana. Estudios epidemiológicos han demostrado que pacientes onco-hematológicos con la misma patología de base y similares factores de riesgo y condiciones clínicas presentan grados muy diferentes de susceptibilidad a infecciones fúngicas invasivas como la AI, sugiriendo la existencia de una predisposición genética a desarrollar este tipo de enfermedad. Este hecho, unido a la dificultad de diagnosticar las enfermedades fúngicas invasoras en sus fases iniciales, pone de manifiesto la enorme utilidad de identificar biomarcadores genéticos que nos permitan predecir qué pacientes son potencialmente susceptibles a la infección, ya que nos daría la oportunidad de diseñar una estrategia profiláctica adecuada para cada paciente.
En el contexto de un consorcio internacional, AspBIOmics, nuestro grupo de investigación desarrolla esta línea de investigación basada en el estudio de polimorfismos genéticos a gran escala y el desarrollo de ensayos funcionales para la identificación de biomarcadores genéticos que, según nuestra hipótesis de partida, condicionan el grado de susceptibilidad y respuesta a antifúngicos. En este consorcio los esfuerzos no sólo están orientados a la búsqueda de biomarcadores genéticos que permitan predecir la susceptibilidad o respuesta a fármacos sino que también pretendemos evaluar una serie de ensayos para la detección de elementos propios del hongo Aspergillus (ARN, polisacáridos o proteínas) o del paciente (perfil de citoquinas, quimioquinas, etc…) en una estrategia multiparamétrica que esperamos nos permita caracterizar la enfermedad para el posterior desarrollo de reactivos y/o kits comerciales. Información más detallada sobre la actividad que estamos desarrollando, así como sobre los grupos científicos que forman parte de esta iniciativa, puede encontrarse en la página web de nuestro consorcio (www.aspBIOmics.eu).
Línea 4: Genética de los tumores sólidos: Cánceres colorrectal, de páncreas y de próstata
Los cánceres colorrectal, de próstata y de páncreas son tres tipos importantes de cáncer que afectan a diferentes tejidos. El cáncer colorrectal es uno de los más comunes en todo el mundo, con una estimación de 152.810 nuevos casos y 53.010 muertes previstas en Estados Unidos en 2024. Es la segunda causa de muerte por cáncer en Estados Unidos, y las revisiones periódicas, en particular la colonoscopia, pueden detectar el cáncer en estadio temprano y prevenir su desarrollo mediante la extirpación de pólipos precancerosos. Los síntomas pueden incluir cambios en los hábitos intestinales, sangre en las heces, dolor abdominal y pérdida de peso inexplicable, con factores de riesgo como antecedentes familiares, afecciones hereditarias y antecedentes personales de pólipos. El cáncer de próstata, el segundo cáncer más frecuente entre los varones después del cáncer de piel, se desarrolla en la glándula prostática y afecta a unos 13 de cada 100 varones a lo largo de su vida. El cáncer de próstata en estadios tempranos rara vez causa síntomas, y entre los factores de riesgo se incluyen la edad, la raza y los antecedentes familiares. Las opciones de tratamiento varían según el estadio y pueden incluir cirugía, radiación o terapia hormonal. El cáncer de páncreas, aunque menos frecuente, es conocido por su agresividad y mal pronóstico, y está vinculado a antecedentes familiares de cáncer de páncreas, que también aumentan el riesgo de padecer otros tipos de cáncer, como el de mama, ovario, colon, próstata, hígado y vías biliares.
La investigación ha puesto de manifiesto conexiones entre estos cánceres que comparten factores de riesgo comunes, en particular la predisposición genética y los antecedentes familiares, lo que hace que las revisiones periódicas y un estilo de vida saludable sean esenciales para la detección precoz y la prevención. Aunque en las últimas décadas las estrategias quirúrgicas primarias para tumores sólidos han cambiado evolutivamente y han mejorado notablemente los resultados de la enfermedad tanto a corto como a largo plazo, una alta proporción de pacientes sigue experimentando graves recaídas de la enfermedad que conducen a cortos periodos de supervivencia global (SG). Además, es importante señalar que estos cánceres se caracterizan por un marcado grado de heterogeneidad, con pacientes que presentan enfermedades muy estables hasta pacientes con enfermedades rápidamente progresivas que están destinados a sucumbir en poco tiempo. Debido a esta gran heterogeneidad, a menudo se requieren varios años de tratamiento, por lo que los costes económicos del cuidado de los pacientes con cáncer suelen ser extremadamente elevados. Actualmente no existen herramientas clínicas que tengan en cuenta la heterogeneidad en el curso clínico de estos cánceres, lo que limita enormemente las oportunidades de intervención precoz y prevención. En este desalentador contexto, urge definir nuevos enfoques para identificar nuevos biomarcadores moleculares para el desarrollo de «scores genéticos/genómicos» de diagnóstico y pronóstico que permitan predecir el desarrollo de estas enfermedades e implementar nuevas estrategias terapéuticas más individualizadas y económicamente viables.
OTRAS ÁREAS DE INTERÉS
Base genética de la artritis reumatoide y la espondilitis anquilosante
La artritis reumatoide (AR) y la espondilitis anquilosante (EA) son enfermedades inflamatorias crónicas que afectan las articulaciones, pero difieren en varios aspectos como la edad de aparición, la prevalencia según el sexo y las asociaciones genéticas. La EA suele comenzar a una edad más temprana, alrededor de los 28 años, en comparación con la AR, que generalmente se inicia entre los 40 y 50 años. Además, la EA afecta predominantemente a varones, mientras que la AR es más común en mujeres. Las asociaciones genéticas de estas enfermedades son significativas, ya que el 95 % de los pacientes con EA son positivos para HLA-B27, mientras que el 60 % de los pacientes con AR presentan positividad para HLA-DR4 o DR1, lo que resalta la importancia del análisis genético en el diagnóstico y tratamiento. La AR afecta principalmente a las articulaciones periféricas, como las de las manos y los pies, mientras que la EA impacta sobre todo en la columna vertebral y las articulaciones sacroilíacas, con posible compromiso de articulaciones más grandes. En las radiografías, la AR muestra reabsorción ósea con cambios erosivos, mientras que la EA se caracteriza por la formación ósea con sindesmofitos vertebrales. Ambas enfermedades presentan síntomas distintos: la AR causa dolor articular, hinchazón, rigidez y fatiga, mientras que la EA provoca dolor en la parte baja de la espalda y caderas que mejora con el ejercicio. Las pruebas genéticas desempeñan un papel fundamental en la confirmación del diagnóstico, ya que ayudan a diferenciar entre estas afecciones y orientan el tratamiento. Aunque los AINEs y los fármacos bloqueadores del TNF-alfa son eficaces en ambas enfermedades, los FAME son fundamentales en la AR, pero tienen un uso limitado en la EA. Hasta la fecha, se han identificado varios marcadores genéticos asociados con la respuesta a los FAME y los fármacos anti-TNF, lo que confirma la importancia de las pruebas genéticas en el manejo de los pacientes.
La coexistencia de ambas enfermedades es poco común, pero ha sido observada, y los pacientes que presentan tanto AR como EA suelen mostrar síntomas más graves y cambios radiológicos más marcados. Aunque la AR y la EA comparten algunas características como enfermedades inflamatorias crónicas, poseen vínculos genéticos, manifestaciones clínicas y respuestas al tratamiento diferentes, lo que subraya la necesidad de realizar pruebas genéticas precisas para garantizar un manejo eficaz.
Los factores genéticos implicados en el desencadenamiento de la AR y la EA han sido objeto de una intensa investigación; sin embargo, hasta la fecha, solo unos pocos estudios han explorado la relación entre la presencia de alteraciones genéticas y las diferencias de susceptibilidad asociadas al sexo en estas enfermedades. Teniendo en cuenta estos hechos, nuestro grupo de investigación se centra en identificar variaciones genéticas asociadas al sexo en genes del sistema inmunológico que estén relacionadas con un mayor riesgo de desarrollar AR y EA. Además, nuestro grupo está estudiando factores genéticos superpuestos y si la interacción entre alteraciones genéticas y factores ambientales modula el riesgo de desarrollar ambas enfermedades.
PLATAFORMAS TECNOLÓGICAS
Large-scale genotyping techniques
Massive Genotyping – Infinium® HD Beadchips, Illumina® Technology
iSelect HD Custom Genotyping, Illumina® Technology
Small Scale Genotyping – 7500 Technology Real Time PCR System (TaqMan® Applied Biosystems, KASPar® KBiosciences)
ImmunoChip (Illumina® Technology).
Bulk Sequencing
Sequencing
Illumina® Sequencing Technology
Gene Expression
CodeLink Platform (Applied Microarrays)
CodeLink Human Whole Genome Arrays
CodeLink Mouse Whole Genome Arrays
Functional Assays
AGENCIAS FINANCIADORAS DE LOS PROYECTOS DEL GRUPO
– ERA-NET Pathogenomics
– Carlos III Institute of Health (ISCIII).
– Ministry of Economy and Business.
– Ministry of Science and Innovation.
– Ministry of University, Research and Innovation.
– Ministry of Health and Consumer Affairs.
– Regional Ministry of Health and Families.
– Regional Ministry of Innovation, Science and Enterprise. Regional Government of Andalusia
– Office for the Transfer of Research Results (OTRI) – UGR.
– Celgene
– Roche-Pharma
– Andalusian Rheumatology Foundation
INTERNACIONALIZACIÓN
Coordination and participation in national and international consortia.
– CIBER (Center for Biomedical Research Network)
– InterLymph (Malignant Hemopathies)
– IMMEnSE (Multiple Myeloma)
– CRuCIAL (Chronic Lymphocytic Leukemia)
– NuCLEAR (Acute Myeloid Leukemia)
– aspBIOmics (Invasive Fungal Infections)
– IMPULSE (Myelodysplastic Syndrome)
– MIRACLE (Myeloproliferative Syndromes)
– GECCO (Colorectal Cancer)
– PRACTICAL (Prostate Cancer)
– REPAIR (Rheumatoid Arthritis and Ankylosing Spondylitis)
Número de expediente: PPJIB2023-126
IP: Dr. Antonio José Cabrera
Entidad financiadora: UGR
Periodo de ejecución: 01/01/2024 – 31/12/2024








