
Áreas científicas de interés
En el Landeira lab creemos que muchos aspectos de la salud humana no están predeterminados genéticamente. Nuestra hipótesis es que la aparición de enfermedades asociadas al envejecimiento es en parte consecuencia del deterioro de la memoria epigenética celular, lo que a la larga conduce a cambios en la identidad celular y a la aparición de enfermedades asociadas al envejecimiento, incluido el cáncer. Nuestro objetivo es contribuir a establecer los fundamentos moleculares de la memoria epigenética, identificar cuáles son las vías epigenéticas clave que inducen el envejecimiento y la progresión del cáncer, y contribuir al diseño de nuevas terapias que reviertan las enfermedades asociadas al envejecimiento.
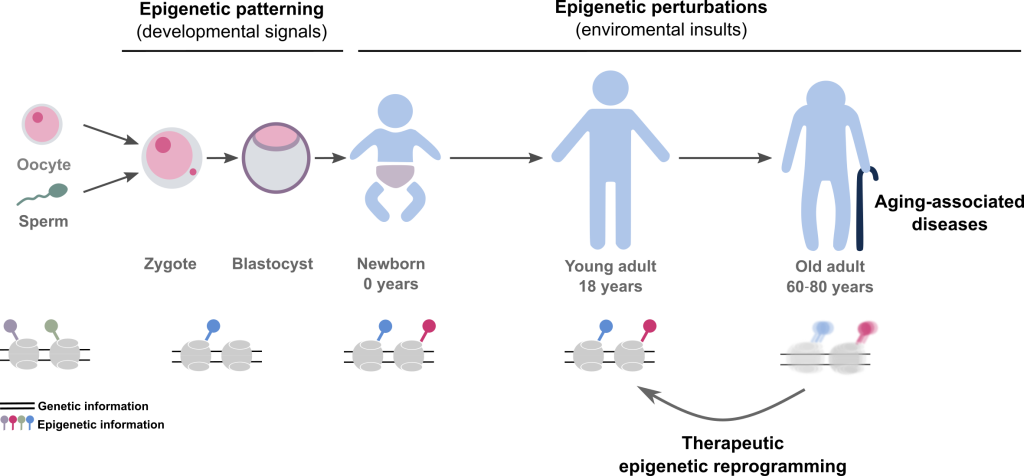
Figura 1. Esquema resumen del interés general del laboratorio en epigenética durante el desarrollo embrionario y en enfermedad humana.
Somos un grupo multidisciplinar afiliado al Departamento de Bioquímica y Biología Molecular II de la Universidad de Granada.
Más información: www.landeiralab.ugr.es
Líneas de investigación
Agencias financiadoras de los proyectos del grupo
Plataformas tecnológicas
Información complementaria
Más información en: www.landeiralab.ugr.es
Investigador Principal
David Landeira
Investigadores Predoctorales
Mencía Espinosa Martínez
Iván Fernández Rengel
Jiajun Xie
Andrea Serrano
Investigadores Sénior
Efres Belmonte-Reche
Lourdes López-Onieva
Antonio Sánchez Pozo
Investigadores Postdoctorales
María Alcázar Fabra
Joan Domingo Reinés
Amador Gallardo de los Reyes
Maria Romo Lozano
Técnico de laboratorio
Fátima Jiménez Serrano
Estudiantes en Prácticas
Sergio Ruiz Caride
Adrián Castillo Linde
Sergio Serrano Corral
David Sánchez Gómez
Publicaciones más relevantes
 Cargando publicaciones...
Cargando publicaciones...Financiador: AGENCIA ESTATAL DE INVESTIGACIÓN
Expediente: PID2022-137060NB-I00
Cantidad total: 250.000,00 €
Tiempo ejecución: 01/09/2023 - 31/08/2026
IP: DAVID LANDEIRA
Dissecting the epigenetic cycle in stem cells
Financiador: INSTITUTO DE SALUD CARLOS III
Expediente: IHRC22/00007
Cantidad total: 942.277,34 €
Tiempo ejecución: 01/01/2023 - 01/12/2025
IP: DAVID LANDEIRA
Programa Emergia
Financiador: CONSEJERÍA DE UNIVERSIDAD, INVESTIGACIÓN E INNOVACIÓN
Expediente: EMC21_00253
Cantidad total: 139.000,00 €
Tiempo ejecución: 01/01/2023 - 01/12/2026
IP: CRISTINA REQUENA
Proyectos de Investigación Precompetitivos para Jóvenes Investigadores. Modalidad A Jóvenes Doctores
Financiador: UNIVERSIDAD DE GRANADA
Expediente: UGR-P20.2022
Cantidad total: 1.000,00 €
Tiempo ejecución: 01/01/2023 - 01/12/2023
IP: DAVID LANDEIRA
Proyecto Impulsa Severo Ochoa
Financiador: CRG
Expediente:
Cantidad total: 15.000,00 €
Tiempo ejecución: 01/01/2022 - 31/12/2022
IP: AMADOR DE LOS REYES
Reclutamiento de Polycomb durante la transición de ciclo celular
Financiador: AGENCIA ESTATAL DE INVESTIGACIÓN
Expediente: EUR2021-122005
Cantidad total: 100.000,00 €
Tiempo ejecución: 01/12/2021 - 01/11/2023
IP: DAVID LANDEIRA
Mitotic bookmarking by Polycomb proteins in stem cells
Financiador: CONSEJERÍA DE UNIVERSIDAD, INVESTIGACIÓN E INNOVACIÓN
Expediente: P20_00681
Cantidad total: 70.000,00 €
Tiempo ejecución: 01/07/2021 - 01/12/2022
IP: DAVID LANDEIRA
Función de las proteínas Polycomb como reguladores de la diferenciación durante el ciclo celular de células pluripotentes
Financiador: UNIVERSIDAD DE GRANADA
Expediente: A-BIO-6-UGR20
Cantidad total: 50.000,00 €
Tiempo ejecución: 01/07/2021 - 01/06/2023
IP: DAVID LANDEIRA
Programa Emergia
Financiador: CONSEJERÍA DE UNIVERSIDAD, INVESTIGACIÓN E INNOVACIÓN
Expediente: EMC21_00253
Cantidad total: 157.008,00 €
Tiempo ejecución: 01/02/2021 - 31/01/2024
IP: CRISTINA REQUENA
Proyectos de investigación para la incorporación de jóvenes doctores a nuevas líneas de investigación en grupos de la Universidad de Granada (Convocatoria 2017)
Financiador: Plan Propio de la UGR
Expediente: ACG125/11
Cantidad total: 126.000,00 €
Tiempo ejecución: 01/02/2021 - 31/01/2024
IP: LOURDES LÓPEZ ONIEVA
MARÍA ZAMBRANO
Financiador: MINISTERIO DE CIENCIA, INNOVACIÓN Y UNIVERSIDADES
Expediente:
Cantidad total: 72.672,00 €
Tiempo ejecución: 01/02/2021 - 31/01/2024
IP: CRISTINA REQUENA
MARÍA ZAMBRANO
Financiador: MINISTERIO DE CIENCIA, INNOVACIÓN Y UNIVERSIDADES
Expediente: MZ2021-160
Cantidad total: 72.672,00 €
Tiempo ejecución: 01/02/2021 - 31/01/2024
IP: EFRES BELMONTE
Estudio funcional de las proteínas Polycomb en la formación de bucles de cromatina y regulación génica durante el ciclo celular en células madre pluripotentes
Financiador: AGENCIA ESTATAL DE INVESTIGACIÓN
Expediente: PID2019-108108GB-I00
Cantidad total: 157.300,00 €
Tiempo ejecución: 01/06/2020 - 01/05/2023
IP: DAVID LANDEIRA
 Intranet
Intranet
